Убийца иммунитета. Российские ученые объяснили, как коронавирус истребляет иммунные клетки человека
Фото: Kathleen Flynn / Reuters
Российские ученые Национального медицинского исследовательского центра гематологии, МГУ и других научных организаций обнаружили возможный механизм снижения числа лимфоцитов — основных клеток иммунной системы — при COVID-19. До сих пор точная причина этого состояния остается неизвестной, несмотря на многочисленные гипотезы. «Лента.ру» подробно рассказывает о новом исследовании, опубликованном в журнале Viruses, которое раскрывает наиболее вероятную причину лимфопении.
Катастрофа с лимфоцитами
Коронавирусная пандемия унесла жизни свыше четырех миллионов человек по всему миру. Самой частой причиной смерти становится сочетание тяжелого острого респираторного дистресс-синдрома, нарушения свертываемости крови и цитопении — дефицита определенных типов клеток крови. У 80 процентов пациентов с умеренным и у 96 процентов с тяжелым COVID-19 наблюдается лимфопения, выражающаяся в дефиците лимфоцитов. Именно содержание лимфоцитов ниже тысячи на микролитр связано с тяжелым течением COVID-19.
Лимфоцит
Фото: National Cancer Institute
Существует несколько предполагаемых механизмов развития лимфопении. Один из них заключается в том, что вирусные частицы SARS-CoV-2 распространяются во внелегочной среде и напрямую воздействуют на ткани периферических лимфоидных органов: селезенку и лимфатические узлы средостения, которые фильтруют лимфу, поступающую из легких. Проникновение коронавируса в лимфатические узлы было подтверждено при вскрытии грудной стенки умерших пациентов с COVID-19, у которых была выявлена лимфоденопатия. Кроме того, увеличение лимфатических узлов было выявлено у шести процентов пациентов, госпитализированных с коронавирусной инфекцией, и у 66 процентов с тяжелой формой COVID-19.
пациентов страдают от уменьшения числа лимфоцитов при умеренном COVID-19
Развитие лимфопении из-за инфицирования и массовой гибели Т-лимфоцитов было также описано при других коронавирусных инфекциях — SARS-CoV и MERS-CoV. Коронавирус может оказывать прямое воздействие на иммунные клетки или вызывать их апоптоз (запрограммированную клеточную гибель) опосредованно, через сигнальные пути. Это показано на пациентах из Ирана, у которых наблюдалась корреляция между интенсивностью лимфопении и усилением программированной клеточной гибели лимфоцитов. Однако до сих пор у ученых не было в распоряжении данных, доказывающих прямое инфицирование лимфоцитов вирусными частицами SARS-CoV-2 у пациентов с COVID-19.
Мутирующий вирус
В ходе исследования ученые использовали фиксированные формалином и парафином образцы тканей легких и лимфатических узлов, взятые для гистологического исследования при аутопсии 36 пациентов, умерших от COVID-19. Из них выделяли РНК, которую затем конвертировали в комплементарную ДНК через обратную транскрипцию. Количественная оценка генетического материала вирусов проводилась с помощью полимеразной цепной реакции (ПЦР). Это позволило специалистам точнее определить, насколько сильно SARS-CoV-2 распространился в рассматриваемых тканях.
В зависимости от штамма коронавирус может оказывать различное действие на клетки человеческого организма. Штаммы, вызывающие беспокойство среди медицинских специалистов, различаются мутациями в так называемом белке-шипе или S-белке, которые затрагивают рецептор-связывающий домен или его окружение. Этот домен прикрепляется к рецептору ACE2, находящемуся на поверхности заражаемых клеток, и помогает вирусным частицам проникать внутрь. Известно, что прежде всего поражаются те ткани и органы, клетки которых экспрессируют ACE2. Экспрессия ACE2 у лимфоцитов превращает иммунные клетки в потенциальные мишени для коронавируса, разные штаммы которого могут действовать на них особым образом.
Для учета штаммов SARS-CoV-2 ученые провели секвенирование генетического материала по Сэнгеру. Этот один из самых популярных методов секвенирования заключается в определении последовательности нуклеотидов в интересующем гене, который многократно копируется. При этом к растущим копиям может случайным образом прикрепляться один из четырех типов модифицированных нуклеотидов, помеченных специальными флуоресцентными метками, после чего синтез копии обрывается. В результате в пробирке возникает множество фрагментов одного и того же гена разной длины, а метки позволяют выяснить, какой нуклеотид на каком месте находится.
Результаты секвенирования выявили случай коинфекции сразу двумя вариантами коронавируса — с.23191C и c.23191T. Мутация, возникшая в гене S-белка, не вызывала аминокислотной замены в самом белке (такие мутации называют синонимичными), поэтому в способности заражать клетки оба варианта не отличались. Это можно объяснить тем, что для SARS-CoV-2 характерна высокая частота мутаций, и в организме зараженного человека могут возникать несколько субпопуляций вируса.
К сожалению, результаты не дали никаких новых данных о том, как различные штаммы влияют на поражение лимфоцитов. Однако ученые сделали интересное открытие, когда изучали клетки и ткани напрямую, через электронный микроскоп.
Прямое заражение
Сначала ученые проверили связь лимфопении с вирусной нагрузкой. Все 36 пациентов были разделены на три группы в зависимости от уровня коронавируса в тканях и органах. В первую группу вошли три пациента, у которых SARS-CoV-2 не был обнаружен ни в одном из органов. Во вторую группу вошли пациенты с диссеминированным коронавирусным поражением легких. В третьей группе коронавирус распространился не только на легкие, но также на лимфатические узлы и селезенку. Количество дней, проведенных в больнице до момента смерти, во второй и третьей группе составили 18,5 и 7 дней, а частота лимфопении — 58,3 и 71,4 процента, соответственно. Более короткий период пребывания в отделении интенсивной терапии был связан с более высоким уровнем вирусной нагрузки SARS-CoV-2 в легких и внелегочным распространением вируса во вторичные лимфоидные органы.
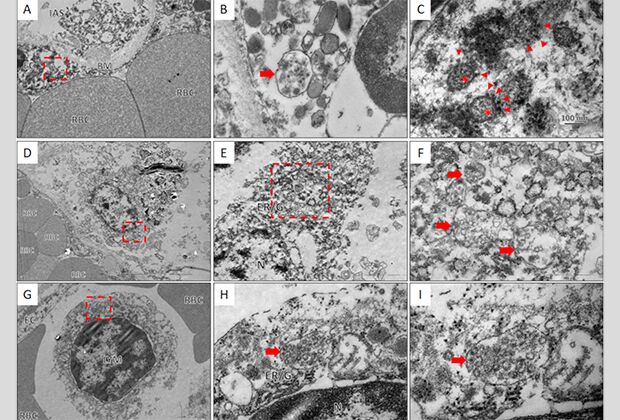
Электронная микроскопия тканей легких. Красные стрелки указывают на следы вирусов
Фото: mdpi.com
Исследователи не нашли никакой корреляции между тяжестью лимфопении и вирусной нагрузкой в лимфатических узлах и селезенке. Как отмечают авторы работы, некоторые ученые полагали, что лимфопения при COVID-19 обусловлена прямым повреждающим воздействием SARS-CoV-2 на ткани вторичных лимфоидных органов. Однако этому противоречит результат: значительный дефицит лимфоцитов наблюдался даже у тех пациентов, у которых селезенка и лимфатические узлы не были затронуты коронавирусом. И наоборот, у некоторых пациентов с диссеминацией коронавируса в тканях селезенки лимфопения не наблюдалась.
Трансмиссионная электронная микроскопия (ТЭМ) раскрыла ученым кое-что интересное: вирионы (полноценные вирусные частицы) внутри клеток. Так, в цитоплазме одного из лимфоцитов был обнаружен пузырек с многочисленными вирусными частицами SARS-CoV-2.
Как пишут авторы работы, это первый известный им случай наблюдения прямого инфицирования коронавирусом лимфоцитов у пациентов с COVID-19. Это открытие подтверждает гипотезу, согласно которой лимфопения может возникать не из-за поражения лимфатических тканей, а из-за того, что SARS-CoV-2 проникает непосредственно внутрь лимфоцитов и активно размножается внутри них, оказывая цитотоксический эффект.